Práctica 6: Análisis de cinética enzimática sobre enzima libre e inmovilizada de distintos extractos
- Admin

- 2 jun 2017
- 9 Min. de lectura
Objetivo general
Realización y discusión de la cinética enzimática para el análisis de variables como temperatura, pH, concentración de sustrato y velocidad sobre enzima libre e inmovilizada en perlas de alginato de distintos extractos de alfa amilasas.
Objetivos particulares
Selección de las variables óptimas: (temperatura, pH, concentración de sustrato y tiempo de incubación) para la actividad enzimática de la alfa amilasa de los extractos en los diferentes microorganismos.
Construcción de la curva de calibración de la concentración de enzima para cada variable.
Cuantificación de proteína total por el método de Bradford
Determinación de actividad enzimática por el método de DNS
Introducción
Conocemos ya lo que es una enzima, como trabaja, la clasificación de estas y sus muchas aplicaciones en la industria por lo que ahora corresponde conocer sobre su cinética.
La cinética enzimática tiene por objeto el estudio de la velocidad de las reacciones catalizadas por las enzimas, los factores que en ella influyen y los mecanismos por los cuales transcurren.
Recordemos primeramente el proceso enzimático:

Primero el sustrato (S) y la enzima (E) se unen y forman un complejo enzima-sustrato (ES), este o bien se disocia en enzima más el sustrato o se transforma el sustrato en producto formando el complejo enzima-producto (EP), que se disocia para dar enzima (E) más producto (P).
La cinética se puede medir por factores clave tales como la cantidad de sustrato que desaparece en cierto tiempo, y la cantidad de producto que se genera. Uno de los factores clave que afectan la velocidad de una reacción catalizada por un enzima es la concentración de sustrato presente, (S) que cambia durante el transcurso de una reacción a medida que el sustrato se convierte en producto. Una aproximación para simplificar los experimentos cinéticos consisten en medir la velocidad inicial, Vo, de acuerdo con (Bravo, 2013).
Ecuación de Michaelis-Menten
La cinética de Michaelis establece que durante una reacción catalizada por una enzima, reacciona reversiblemente con el sustrato para formar un complejo: ES, que participa en una reacción para dar origen a un producto y la enzima libre y activa, según (Cornish, 2013). La velocidad de transformación de sustrato en producto en una reacción enzimática depende:
La cantidad de sustrato presente. [S]
La afinidad del enzima por el sustrato. [Km]
La cantidad de enzima presente. [E]
La constante de Michaelis (Km) nos indica la concentración de sustrato a la cual la velocidad de reacción es la mitad de la velocidad máxima.

Este parámetro es independiente de la concentración de enzima, y es característico de cada enzima según el sustrato utilizado, cuanto mayor es Km menor es la afinidad (predominan las formas E y S libres), cuanto menor es Km mayor es la afinidad (predomina la forma ES).
La velocidad máxima Vmáx estima el número de centros activos del enzima, se alcanza cuando todos los centros activos están ocupados con sustrato.

A la constante k2 (poder catalítico del enzima) se la reconoce con el nombre de número de recambio, es el número de moléculas de sustrato convertidas en producto por unidad de tiempo. Por lo que la Vmáx depende de dos cosas, la cantidad de enzima presente y la capacidad catalítica del enzima, es decir la velocidad con que transforma al sustrato.(Cornish, 2013)
La ecuación de Michaelis-Menten se puede transformar algebraicamente en formas más útiles para representar los datos experimentales, tal como la ecuación de denominada ecuación de Lineweaver-Burk.

Para el sustrato se utilizan las unidades de moles (M), micromoles (µM), gramos (g) o microgramos (µg). La unidad para la actividad enzimática es la U, se define como la actividad catalítica de un µmol de sustrato por minuto, también se pueden utilizar los µg o mL.
En este trabajo se utiliza la unidad U como µg de producto por µg de enzima por minuto. (Rivera et al, 2007)
La velocidad de acción de un enzima también se puede ver afectada por la presencia de inhibidores, que pueden actuar de diferentes maneras.
El inhibidor y el sustrato compiten por el sitio activo de la enzima. La actividad enzimática se puede inhibir, es decir, reducir o eliminar la actividad enzimática o catalítica de enzimas específicas. Existen diferentes tipos: competitiva, no competitiva y acompetitiva. (Purich, 2009)
El inhibidor competitivo es muy similar al sustrato normal de la enzima. Dada esa similitud estructural, este tipo de inhibidor se une reversiblemente al sitio activo de la enzima. Si se aumenta la concentración de sustrato el inhibidor puede ser desplazado del sitio activo. Afecta la Km de la enzima y la Vmax se mantiene. La Vmax se mantiene constante con o sin inhibidor competitivo.
Gráfica: Sin embargo, cuando está presente el inhibidor Km aumenta y Vmax nunca se alcanza.

La unión del inhibidor afecta la configuración tridimensional de la enzima y bloquea la reacción. Este tipo de inhibidor no compite directamente con el sustrato para unirse a la enzima (no afecta la unión ES), por lo tanto, este tipo de inhibición no es reversible cuando aumenta la concentración del sustrato.
Gráfica: Esta inhibición disminuye la Vmax según aumenta [ I ], pero no afecta Km (la enzima puede unirse al sustrato).

El inhibidor se combina sólo con el complejo ES (no con la enzima), por lo que el inhibidor ejerce su efecto sólo a altas concentraciones de sustrato en las que hay gran cantidad de complejo ES. Por lo tanto, variando la [S] no afecta o evita la unión con el inhibidor, todas estas inhibiciones de acuerdo con (Murzin et al., 2016)
Tabla 1. Comparación de tipos de inhibición.

Sobre la reacción de alfa amilasa
Recordemos según (Gupta et al., 2003) que la alfa amilasa es una enzima de naturaleza gluproteica que existe en seis forma moleculares (isoenzimas). Tiene un pH óptimo de 6 a 8, siendo en C1 su principal activador, y una temperatura óptima de 37°C. La enzima alfa amilasa es activa a un pH de entre 4 a 11.
Por otra parte el almidón está formado por dos tipos de moléculas: la amilosa y amilopectina (polisacáridos de glucosa).
La alfa amilasa rompe las uniones C1-C4, tanto en la amilosa como en la amilopectina, dejando dextrinas lineales y ramificadas (oligosacáridos) como productos, estos productos serán la glucosa y maltosa. Estas atacan al almidón al azar y nunca por los extremos por lo que se produce un cambio de coloración en el complejo yodo-almidón.(Schellart et al.,1976)
Metodología experimental
Resultados
Discusión
Se identificó y caracterizó la enzima alfa amilasa provenientes de diferentes microorganismos, conociendo para cada uno su velocidad, pH, temperatura y concentración de sustrato óptimo; para la construcción de la curva de calibración de la enzima. La condiciones óptimas se encontraron ya que en estas la enzima presentaba mayor actividad enzimática, determinando ésta por el método de DNS (veáse en la Práctica 1).
Sobre el pH
La mayoría de los enzimas presentan un pH óptimo para el cual su actividad es máxima; por encima o por debajo de ese pH la actividad disminuye bruscamente.
Este efecto se debe a que, al ser los enzimas de naturaleza proteica, al igual que otras proteínas, se desnaturalizan y pierden su actividad si el pH varía más allá de unos límites. En la mayor parte de los casos el pH óptimo está próximo a la neutralidad de acuerdo con (Purich, 2009)
Cuando la actividad de la enzima fue ensayada con diferentes valores de pH, la máxima actividad se obtuvo con pH 5.
Las amilasas son generalmente estables a pH 5.5 a 8.0, la actividad óptima normalmente ocurre entre pH 4.8 a 6.5, existen diferencias en las formas de las curvas de actividad de pH de las diferentes enzimas de amilasas y también en los valores de pH óptimo (Maning y Cambell, 1961) por lo que en la mayoría de estas tienen su pH óptimo en el rango ligeramente ácido a neutro.
Luego de la incubación de la enzima entre 10 - 25 min en buffer de diferente pH, se observa que la enzima fue estable en el rango de pH 5-7.
Rangos de estabilidad en el pH similares han sido reportados para las α-amilasas de Aspergillus awamori y Thricoderma viride.
Sobre la temperatura
La variación de la actividad enzimática con la temperatura es diferente de unas enzimas a otras.
En las reacciones catalizadas por enzimas se produce un brusco descenso de la actividad cuando se alcanza una temperatura crítica. Este efecto no es más que un reflejo de la desnaturalización térmica del enzima cuando se alcanza dicha temperatura. de acuerdo a (Purich, 2009).
Para el caso de nuestra enzima, la temperatura a la cual se alcanza la máxima actividad y, por tanto, corresponde a la temperatura óptima de reacción, es 50°C. Cuando se sobrepasa este valor, la actividad disminuye rápidamente porque la enzima se va desnaturalizando.
Según Fogarty (1973) la temperatura óptima de la enzima proveniente del microorganismo A. niger es de 60ºC y la proveniente de A. orizae es de 40ºC.
Comparando los resultados en temperatura de la enzima libre y la enzima inmovilizada, se obtuvieron valores mayores para la enzima inmovilizada que para la enzima libre. Las altas temperaturas de la enzima inmovilizada pueden resultar de una temperatura más baja en el microambiente de las perlas que en la solución a su alrededor (Riaz, A. et al, 2009).
Sobre la concentración
Se manejaron distintas concentraciones de almidón soluble como sustrato, realizando un stock de 10µg/mL.
Debido a que los análisis de actividad enzimática que se realizan en distintos trabajos publicados, las concentraciones de sustrato y éste mismo, varían mucho. Por lo que no podemos tener una comparación precisa. Sin embargo, realizaremos comparaciones entre los mismos parámetros cinéticos.
Sobre parámetros cinéticos
Los parámetros Km y Vmax cambian de una enzima a otra, proporcionan poca información respecto al número, velocidad o pasos que se llevan a cabo durante la reacción química entre la enzima y el sustrato. Según Lehninger, 2006:
Km cambia aunque se utilice la misma enzima, si se trabaja con diferentes tipos de sustratos. Vmax es una variable que depende de la concentración de enzima.
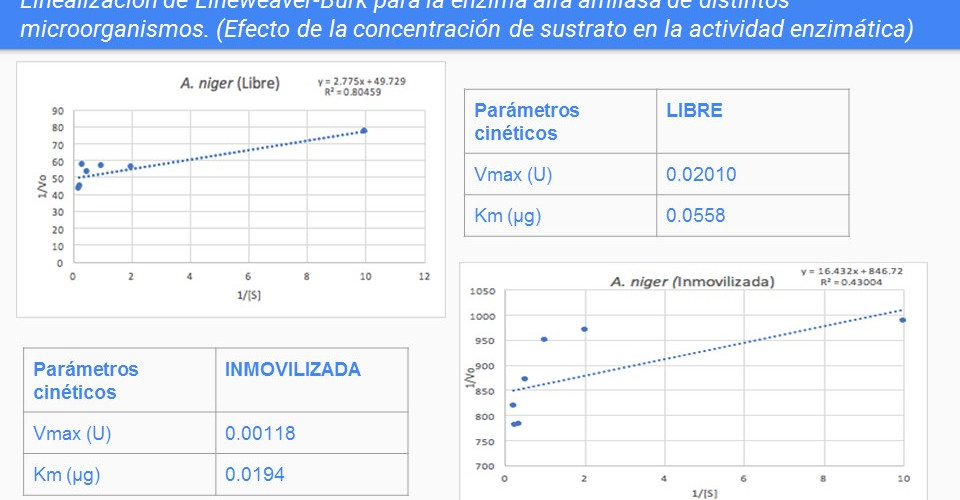
A continuación se presenta la siguiente tabla con los resultados obtenidos de Vmax y Km de los distintos extractos libre e inmovilizados de alfa amilasa:

Podemos observar que las Vmax son pequeñas, describiendo la poca actividad enzimática que tiene nuestra amilasa, pero obtenemos valores pequeños en la mayor parte de los Km, con excepción a S. cerevisiae y comercial libre. Analizando que la enzima obtenida de estos organismos no fue muy a fin a el sustrato.
Para la buena comparación de reacciones enzimáticas, se deben de tener dos parámetros, Lehninger sugiere la cte Km y Kcat. Éste último es conocido como el número de recambio, la cual es el número de moléculas de sustrato convertidas en producto por unidad de tiempo.
Kcat es útil para analizar el comportamiento enzimático cuándo la enzima se encuentra a niveles de sustrato saturadas menores a [S].
En artículos se presentaron resultados de la concentración de enzima en los parámetros cinéticos (Km y Vmáx), provenientes de diversos microorganismos; la α-amilasa de Penicillium commune presenta una cinética típica de Michaelis-Menten y posee una alta afinidad por el almidón soluble respecto a otras α-amilasas microbianas como Thermofibida fusca (0,88 mg/mL)(Yang, 2004), Aureobasidiumpullulans (5,75 mg/mL)(Li, 2007) y Bacillus sp. (1,64 mg/mL)(Uchino, 1982), sin embargo, es muy similar a la del hongo filamentoso Aspergillus fumigatus (0,42 mg/mL) (Planchot, 1995).
Conclusión
Se observó que tanto en la levadura (S. cerevisiae), como en la papa (A. niger), empleados como soporte, permiten el crecimiento de microorganismos que contienen enzima alfa amilasa.
Se cuantificó la proteína total por el método de Bradford, y se determinó la actividad de la enzima proveniente de diferentes microorganismos, por el método de DNS, logrando comparar la enzima libre e inmovilizada para cada uno de los microorganismos, y encontrar en cuál se presento mayor actividad.
La comparación de las cinéticas de producción de la enzima en cultivos en FEL y FES, permite establecer que la fermentación en fase sólida con papa estéril arroja los mejores resultados en cuanto a actividad enzimática de α-amilasa. La enzima presentó un pH óptimo de 5 y fue estable en un rango de pH entre 4 y 5 a 50 °C, siendo está una temperatura óptima para el microorganismo A. niger.
Cuestionario post-laboratorio
1. ¿Cómo afecta la temperatura la cinética de una enzima?
Afecta directamente a la velocidad de la reacción. Cuando la temperatura aumenta, aumenta la velocidad de la reacción hasta que el punto máximo es alcanzado (debido a que aumenta el número de moléculas ricas en energía); si la temperatura disminuye, las enzimas se contienen, y resulta un decremento de la velocidad como resultado de la desnaturalización.
2. ¿Cómo altera el pH lo valores de Km y Vmax?
Cuando la enzima no está en su pH óptimo, no puede alcanzar su máxima actividad. Si se trabaja en rangos muy alejados del pH óptimo (ya sean muy ácidos o muy alcalinos), la enzima se desnaturaliza y se inactiva. En cuanto a Km, este es independiente de la concentración de sustrato.
3. ¿Porqué se realiza la linearización de la ecuación de Michaelis-Menten?
Para obtener de manera más fiable y precisa, el cálculo de Km y Vmáx, la linealización más común, que no es más que una transformación matemática, es la de Lineweaver-Burk.
4. ¿De que dependen los valores de las constantes cinéticas en una reacción enzimática?
De la temperatura, el pH, la concentración de sustrato y la cantidad de enzima.
Referencias
Gupta, R.; Gigras, H.; Mohapatra, H.; Goswami, V.; Chauhan, B. Microbial a-amylases: a biotechnological perspective. Process Biochemistry. 2003. 38: 1599-1616.
Bhella, R.S.; Altosaar, I. Purification and some properties of the extracellular a-amylase from Aspergillus awamori. Can J Microbiol. 1985.31: 149-153.
Purich, D. (2009). Contemporary enzyme kinetics and mechanism. 1st ed. Amsterdam [u.a.]: Elsevier Acad. Press.
Cornish-Bowden, A. (2013). Fundamentals of Enzyme Kinetics. 1st ed. Weinheim: Wiley.
Li, H.; Chi, Z.; Wang, X. D.; Ma, L.; Gao, L. (2007). Purification and characterization of extracellular amylase from the marine yeast Aureobasidium pullulans N13d and its raw potato starch digestion. Enzyme and Microbial Technology.
Murzin, D. and Salmi, T. (2016). Catalytic kinetics: Chemistry and Engineering. 2nd ed.
Planchot, V.; Colonna, P. (1995). Purification and characterization of extracellular alpha-amylase from Aspergillus fumigatus. Carbohydrate Research.
Bravo, A. (2013) Enzimología Clínica. Unidad II. 1 ed.
Schellart, J. A.; Visser, M. W.; Zandstva, T.; Middlehover, W. J. Starch degradation by the mold Trichoderma viride I. The mechanism of degradation. Antonie Van Leeuwenhock J Microbiol Serol. 1976. 42: 229-238.
Rivera E. (2007) Cinética Enzimática, Dpto de Química, Universidad Nacional Autónoma de México.
Uchino, F. (1982). A thermophilic and unusually acidophilic amylase produced by a thermophilic acidophilic Bacillus sp. Agrie Biol. Chem.
Lehninger, A. (2006). Principles of biochemistry, study guide/solutions manual & i-clicker. 1st ed. [Place of publication not identified]: W H Freeman.
Yang, C. H.; Liu, W. H. (2004). Purification and properties of a maltotriose-producing a-amylase from Thermobifida fusca. Journal of Industrial Microbiology and Biotechnology.

























Comentarios